-부작용 최소화 나노입자 신약물질 개발
[데일리비즈온 김소윤 기자] 항암제를 통한 화학요법은 상대적으로 다른 항암 치료 과정보다 비용과 효과면에서 우수하기 때문에 많이 사용된다. 하지만 항암제에 대한 암세포의 내성은 암의 재발을 초래할 수 있다. 이 가운데 국내 연구진이 항암제 내성을 극복할 수 있는 약물을 개발했다.
22일 한국과학기술연구원(KIST)은 테라그노시스연구센터 김광명 박사 연구팀이 항암제 내성을 극복할 수 있는 암세포 특이적 항암제 전구체 약물 개발했다고 밝혔다.
항암제를 통한 화학요법은 암세포를 효과적으로 사멸할 수 있지만 내성이 생길 경우 치료 실패로 이어진다. 암세포는 항암제에 대한 내성을 원래 갖고 있어 화학요법에 좋은 반응을 나타낸 암세포더라도 치료 과정 중 내성이 발생할 수 있는 위험이 있다.
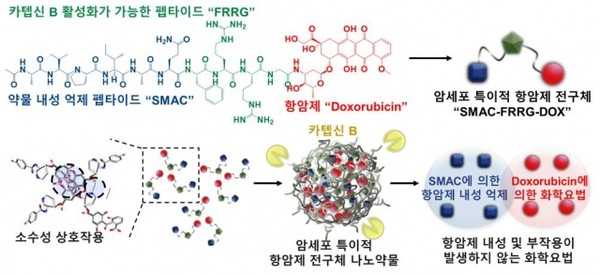
이에 따르면 연구진은 항암제 내성을 억제하는 약물(스맥, SMAC)과 항암제(독소루비신)를 결합시켜 새로운 약물을 만들었다. 개발된 약물은 생체 내에서는 활성화되지 않고 있다가 암세포를 만나게 되면 암세포에서 과발현되는 효소와 반응하는 기전이다.
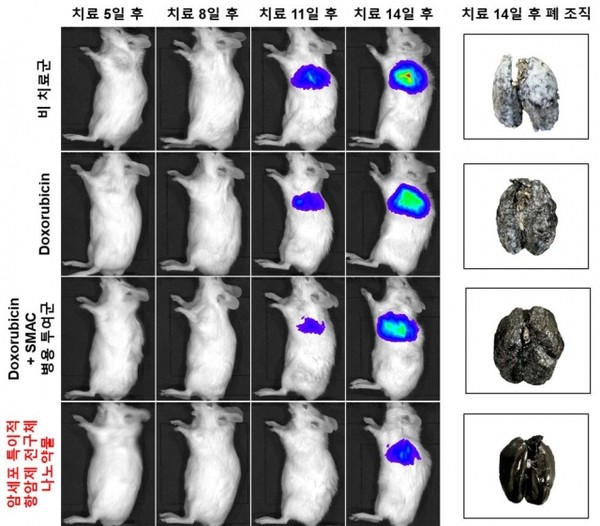
암세포와 반응한 약물은 항암제와 같이 내성 억제제를 방출한다. 이에 효과적으로 항암제 내성을 극복할 수 있다. 또 암세포 공격 효과도 있다. 이 결과 암세포가 갖고 있는 항암제 내성은 물론 치료 과정 중 흔히 나타나는 후천적 항암제 내성까지 억제할 수 있다는 설명이다.
아울러 약물이 암세포와 반응하도록 하는 효소인 카텝신 B는 암세포가 아닌 정상 세포에서는 상대적으로 매우 적은 양이 발현된다. 이에 정상 세포에서는 나노약물이 비활성 상태로 존재하여 독성이 나타나지 않는다. 이에 기존 화학요법의 문제점인 부작용을 감소시킬 수 있을 것으로 보인다는 설명이다.
연구팀 관계자는 “본 암세포 특이적 항암제 전구체 나노약물 기술은 기존 화학요법의 치료 실패를 초래하는 항암제 내성을 효과적으로 억제함과 동시에 정상 세포에 대한 독성을 감소시켜 항암제 내성 및 부작용이 발생하지 않는 새로운 항암제로 활용이 가능할 것으로 기대한다”라고 말했다.
지난해에도 국내 연구진이 대장암 항암제 내성을 극복할 새로운 병용치료 타겟을 발굴했다. 한국과학기술원(KAIST) 바이오및뇌공학과 조광현 교수 연구팀이 개발했는데 이들은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법을 중점으로 제시했다.
이를 통해 암세포가 가지는 약제 내성의 원리를 시스템으로 분석하는 한편 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 보인다. 특히 대장암은 전 세계적으로 환자 수 100만 명을 넘어선 흔한 암이고 발병률 증가 속도가 높아져 이에 따른 사망률도 증가할 우려가 있다.
이 가운데 암세포의 특정 분자만을 표적으로 하는 표적항암제가 부작용을 줄이면서 효과를 높일 화학요법으로 주목받았지만 약물에 호전을 보이는 환자가 제한적이라는 설명이다. 게다가 반응을 보인 환자도 치료 후 내성이 생겨 암이 재발되는 경우가 있다.
또 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 대두된다. 대장암 또한 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이루어지는 상황이다.
미국 식품의약국(FDA) 승인을 받은 대표적인 대장암 치료제인 세툭시맙은 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있다. 의료계는 이 유전자 돌연변이가 없는 환자에게 처방을 권한다.
하지만 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하다는 설명이다. 또 기존 항암 화학요법 단독시행과 비교해도 불과 평균 5개월의 수명이 연장되는 데 그친다.

이에 KRAS 돌연변이 유무 이외의 새 바이오마커가 필요한 상황이다. KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 절실하다.
이에 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 발견했다.
아울러 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다. GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있다고 연구팀은 설명했다.
이에 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있다는 것이다. 연구팀은 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 밝혀냈다.
이들이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감한 환자들을 미리 선별해 치료할 수 있는 정밀의학이 활용되는 것이다.

